المولالية )التركيز الجزيئي الوزني)
Molality
) الجزيئية الوزنية)
تعريفها : هي عدد مولات المادة المذابة في كيلوجرام من
المذيب.
والصيغة الرياضية لها :
ووحدة المولالية هي مولال (molal)
أو mol/ Kg
حيث:
m : المولالية، ورمز لها بحرف مائل تمييزا لها
عن رمز الكتلة m
n2: عدد مولات المذاب
m1 : كتلة المذيب بوحدة الكيلوجرام. والعلاقة
بين الجرام والكيلو جرام هي :
1 kg = 1000 g
ويمكن استخدام وحدة الجرام في قانون المولالية بحيث
يصبح القانون :
مثال/ احسب
التركيز بالمولالية لمحلول تم تحضيره بإذابة (mol2)
من حمض الكلور في g800 من الماء.
الحل
مثال / عند إذابة g20
من كلوريد الصوديوم NaCl في كمية من
الماء بحيث تصبح كتلة المحلول 90g احسب مولالية
المحلول. (الأوزان الذرية :35.5 = Cl , 23= Na).
مثال :احسب
الكسور المولية لمذاب ومذيب في محلول مائي لهيدروكسيد الصوديوم NaOH تركيزه molal0.2 علما بأن الكتل الذرية 1)= H , 16 = (O
لم نعط في المسألة أي وزن للمذيب والمذاب، والتركيز هنا
بوحدة المولالية وهو يساوي (molal) و هو يعني mol 0.2 من المذاب في g1000 من المذيب
وبالتالي فإن عدد مولات المذاب (nNaOH = 0.2 mol )
بينما عدد مولات المذيب :
وبالتالي فعدد المولات الكلي :
وبالتالي فإن الكسور المولية للمذاب والمذيب :
شاهد ايضاً :
·
المول
·
تعريف
المحلول - صور المادة المذابة في المحلول - أنواع المحاليل السائلة
·
تطبيقات على النسبة المئوية
الوزنية
·
الكسر
المولي (الكسر الجزيئي)
·
المولالية
(التركيز الجزيئي الوزني)
·
المولارية
(التركيز الجزيئي الحجمي)
·
العلاقة بين المولارية
والنسبة المئوية الوزنية والكثافة لمحلول
·
التخفيف
·
النسبة المئوية الوزنية
والكسر المولي للمادة النقية
المصادر
·
أحمد عبد العزير العويس
و سليمان حماد الخويطر و عبد العزيز إبراهيم الواصل و عبد العزيز عبد الله السحيباني
، الكيمياء العامة ، دار الخريجي، الرياض، 1996م.
·
جوردن م بارو، الكيمياء
الفيزيائية، ترجمة أحمد محمد عزام، دار ماجروهيل، 1982م.
·
سليمان حماد الخويطر
و عبد العزيز عبد الله السحيباني، الثرموديناميك الكيميائي، دار الخريجي، الرياض، 1998م.
·
سمير مصطفى المدني،
أساسيات الكيمياء العامة، جامعة الملك سعود - النشر العلمي و المطابع، الرياض، 1993م.
·
الكيمياء العامة -
احمد بن عبدالعزيز العويس و آخرون- دار الخريجي للنشر و التوزيع ط2. 1996م.
·
سمير مصطفى المدني
، كتاب أساسيات الكيمياء العامة ، ( منشورات جامعة الملك سعود1997
م.
·
حسن محمد الحازمي و
محمد إبراهيم الحسن ، كتاب الكيمياء العضوية ، مكتبة الخريجي
1990م.
·
Ralph H. Petruccii and William S.
Harwood, General Chemistry, Principle and Modern Applications, Prentice-Hall,
New Gersey, 1997.
·
James E. Brady and John R. Holum,
Chemistry, The study of Matter and its Changes, Wiley, New York, 1993.
·
Petter Atkins and Loretta Jones,
Chemistry, Matter and Change, 3d Edition, W.H. Freedman and Co., New York,
1997.
·
James E. Brady, General Chemistry,
Principles and Structure, 5th Edition, Wiley, New York, 1990.
·
David E. Goldberg, Schaum's
Outline Series, Theory and Problems of Chemistry Foundations, International
Editions, McGraw-Hill, New York, 1991.
·
James E. Brady and John R. Holum,
Fundamentals of Chemistry, 34 Edition, Wiley, New York, 1988.
·
Raymond Chang, Chemistry, 5th
Edition, International Edition, McGraw-Hill, New York, 1994.
·
R. Abu-Etta, Y. Essa and A.
El-Ansary, General Chemistry, Cairo University Press, 1998.
·
P.W. Atkins, Physical Chemistry,
Oxford Press, Oxford, UK, 1982.
·
G.M. Barrow. Physical Chemistry,
MacGraw-Hill, New York, USA, 1996.
·
Maurice Wahba, Hanna A. Rizk, Introduction
to Physical Chemistry, Anglo Egyptian, 1978.
·
Robert A. Alberty and Robert J.
Silby, Physical Chemistry, Wiley, New York, 1992.
·
Whitten, etal , General Chemistry
with Qualitative Analysis , 3rd ed., Saunders college publishing






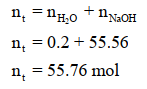
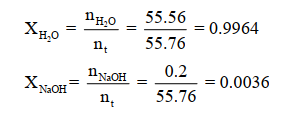
Comments
Post a Comment