ايض الأحماض الامينية
Amino acids
metabolism
تختلف الكائنات الحية في تمثيل الأحماض الامينيه، حيث لاتستطيع
الحيوانات الفقرية ومنها الأنسان من تخليق جميع الأحماض الأمينية وتستطيع الفئران وكذلك
الأنسان من تمثيل عشرة احماض امينية فقط من مجموع عشرين حامض اميني، وعليه يطلق على
هذه الأحماض بالغير أساسية، اما الأحماض العشرة المتبقية والتي لانستطيع تمثيلها فتسمى
بالأحماض الأمينية الأساسية ويجب الحصول عليها من الغذاء المتناول لسد الحاجة.
اما الخلية النباتية فتستطيع تخليق كل الأحماض الأمينية
العشرين من الأمونيا أو النترات كمصدر نتروجين، اما الأحياء المجهرية تختلف اختلافاً
كبيراً بعملية التخليق فمثلاً ال Escherichia Coil تستطيع تخليق كل الأحماض الامينية العشرين بينما بكتريا التخمر اللاكتيكي
التي تسبب حموضة الحليب لاتتمكن من تخليق اي من الأحماض الأمينية العشرين، وعلية يجب
أن تحصل عليها من بيئتها من الغذاء، وتعتبر الأحماض الامينية غير الأساسية أكثر أهمية
للخلية وذلك لأعتماد الخليه عليها.
الأحماض الامينية الأساسية :
lysine - leucine- iso leucine -
histidine - Arginine - Therionin - Valine - Tryptuplan- phenylalanine -
methionine
الأحماض الامينية غير الأساسية :
cysteine- Aspartic acid-
Asparagine- Alanine - gly cine - Glutamin- Glutpimic acid - Tyrosine- Serine
-hydruxy proline
أ- تخليق الأحماض الامينية غير الأساسية من مركبات
الأيض الوسطية:
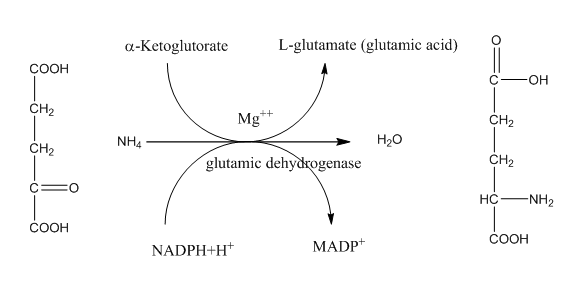
1- تخليق حامض الكلوتاميك
والكلوتامين من a-Ketoglutarate
ان طرق التخليق الحيوي لهذه الأحماض الامينية بسيطة حيث
يتكون حامض الكلوتاميك من الأمونيا و ال الفا كيتو كلوتاريك وهو احد المركبات الوسطيه
في دورة الحامض الثلاثي الكاربوكسيل TCA وبمساعدة
الأنزيم glutamic dehydrogenos
يعتبر هذا التفاعل ذو أهمية قصوى في التخليق الحيوي لجميع الأحماض الامينية وفي جميع الكائنات الحية وذلك لكونه الطريق الرئيسي في تكوين المجموعة الامينية ألفا مباشرة من الأمونيا ويتكون حامض الكلوتاميك المتكون من ان يهب المجموعة الامينية في عمليات تخليق معظم الأحماض الامينية الأخرى، حيث يتكون مشتق حامض الكلوتاميك المتكون المسمى الكلوتامين بمساعدة انزيم glutamine synthetase
ب- تخليق الأحماض الامينية غير الأساسية من احماض
امينية أخرى :
- تخليق البرولين
Proline من الكلوتاميت glutamate
في الثديات وبعض صور الحياة الأخرى يخلق البرولين من glutamate من خلال عدد من التفاعلات الحيوية العكسية الهدمية:
2- تخليق الالانين والأسبارتيك و الأسبارجين
يتكون الالانين وحامض الاسبارتيك بنقل مجموعة امينية من
حامض الكلوتاميك إلى كل من حامض البايروفيك و حامض الأوكزالواسيتك :
وبما ان المركبين حامض البايروفيك و الأوكزالواسيتك هما
من المركبات لدورة الحامض ثلاثي الكاربوكسيل TAC فأن ذرات الكاربون للحامضين الامينيين المخلقين اعلاه يأتيان
من المركبات الوسطيه لدورة TAC اما الأسبارجين
فإنه يخلق من حامض الاسبارتيك بمساعدة انزيم asparagine synthetase
3- تخليق السيرين و الكلايسين من D-3-phosphoglycerate
يعتبر السيرين precarsor حامل للكلايسين حيث انه في المرحلة الأخيرة
يتم تحويل السيرين إلى كلايسين وذلك بفقد السيرين لذرة كاربون بيتا حيث يعطيها إلى
ال Tetrahydrofolate ويتحول
ذلك إلى كلايسين اما تخليق السيرين فيتم بطريقتين في أنسجة الثديات، وفي كلا الطريقتين
يستعمل مركب D-3-phosphoglycerate وهذا المركب
هو وسطي في عملية ال glycolysis
- هو استخدام
المركب الوسطي D-3-phosphoglycerate في عملية
يتم بموجبها اكسدة
phosphoglycerate لأنتاج مركب
phosphohydroxypyruvate ومن ثم نقل مجموعة الامين من a-alonin بعملية trans amination لتكوين مركب phospho serine ومن ثم تحويله إلى serine بمساعدة انزيم phosphate حيث تتم عملية تحلل مائي يزال بموجبها مجموعة
ال phosphate
- وهو استخدام
نفس المركب الوسطي بعملية يتم بموجبها إزالة مجموعة phosphate منه ليتحول إلى glycerate بمساعدة انزيم phosphatos فيتحول
إلى glyceric acid ومن ثم
تتم عملية اكسدة هذا الحامض ليتحول إلى
hydroxypyruvic acid الذي بدوره يأخذ مجموعة الامين a-alanine ليتحول إلى serine
تخليق السيرين بواسطة المركبات الوسطية العضوية وغير العضوية
أما تخليق الكلايسين فيتم بعدة طرق في أنسجة الثديات ففي
سايتوسول سايتوبلازم خلايا الكبد يوجد انزيم ال glycin tronsominose التي تساعد على تخليق الكلايسين من مركبات
ال glyoxylate والحوامض الامينية ال glutamate و ال alanine هناك طريقين مهمين في الثديات لتخليق الكلايسين
من choline و serine بمساعدة انزيم serine hydroxy nethyltransfer
هيدروكسي برولين و هيدروكسي لايسين
Hydroxy lysine
& Hydroxy proline
يعتبر البرولين المركب الذين يخلق منه الهيدروكسي برولين
ولكون البرولين والهيدروكسي برولين يخلقان اصلاً من الكلوتاميت لذا اعتبروا الثلاثة
عائلة واحدة للأحماض الأمينية. ان الهيدروكسي برولين مثل الهيدروكسي لايسين يدخل في
تخليق بروتين الكولاجين الرابط في الثديات، ان الكولاجين يتكون من اللايسين بنسبة الثلث
والبرولين والهيدروكسي برولين بنسبة الثلثين،
بعملية ال
hydroxylation وهي إضافة مجموعة هيدروكسيل للحامض الاميني البرولين والتي تتم
بمساعدة انزيم ال prolyl hydroxylos وهذا الأنزيم
موجود في خلايا أنسجة الجلد، الكبد، الرئة، القلب والعضلات الهيكلية وفي الجروح ان
هذا الأنزيم هو عبارة عن peptidyl
hydroxylose فهو يعمل على إصلاح الأنسجة بعملية تسمى ال hydroxylation للبرولين [وكذلك عمل انزيم اخر مشابه له هو lysyle hydroxylos يعمل على ال lysine فيخلق hydroxy lysine الداخل في
تركيب الكولاجين أيضاً].
أن انزيمات ال hydroxyloses تحتاج لأداء وظيفتها بالأضافة إلى المادة الخاضعه
التي يعمل عليها الأنزيم إلى الأوكسجين الجزيئي O2 الأوكسوربيت و الحديد الثنائي Fe+2 والمركب الوسطي a-Ketoglutarate، ان هذا الأنزيم
يعمل على سحب OH من مجموعة كاربوكسيل
ال a-keto glutarate بعملية decarboxylation تعطيها للبرولين.
ج- تخليق الأحماض الامينية غير الأساسية من احماض
امينية اساسيه:
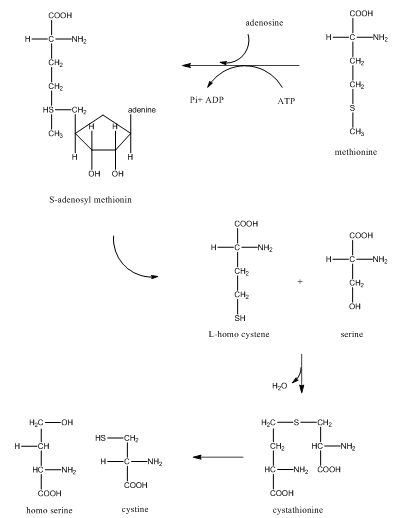
1- تخليق ال
cysteine من ال methionine
يخلق في اللبائن من الميثونين (الأساسي) ومن السيرين (الغير
اساسي) وتشمل عملية التخليق ثلاث مراحل وهي :
- فقد الميثونين مجموعة المثيل CH3 ليتحول إلى هوموستين (homo cysteine) وهذه المرحلة تتم بثلاثة تفاعلات تحتاج الى طاقة ATP لأنجازها وفي نهاية هذه المرحلة يتحول الميثونين إلى صيغته الفعالة المسماة s-adenosyl methioinine.
- يتفاعل الهوموستين مع السيرين بمساعدة انزيم cystathionine synthetase لينتج cysta thionine
- وفي هذه المرحلة يتم تكوين ال cysteine
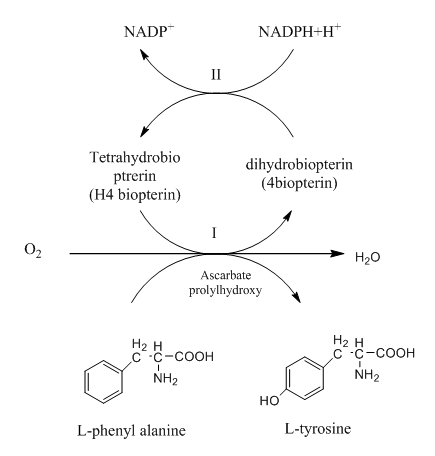
2- تخليق التايروسين
Tyrosine من phenyl alanine
بالرغم من كون التايروسين حامض اميني غير أساسي فأن تخليقه
يحتاج phenylalanine وهو حامض اميني اساسي ويتم
بتفاعل هيدروكسيلي hydroxylation
reaction بمساعدة انزيم ال phenyl alanine hydroxylose الموجود في خلايا أنسجة الكبد فقط في الثديات :
هدم نتروجين الأحماض الامينية
Catabolism of amino
Acids nitrogen
يشمل هذا هدم الأحماض الامينية وانتقال نتروجينها إلى اليوريا
والخلل الأيضي للعملية، ففي انسجة الثديات يكون مصدر الأحماض الامينية أما الغذاء أو
تحطيم وهدم انسجة الجسم البروتينية، ان المجموعة الامينية ألفا لهذه الأحماض يتم تحطيمها
وتحويلها إلى يورياالتي تطرح مع البول، أن عملية هدم نتروجين الأحماض الامينية وتخليق
اليوريا بنفس الوقت يمكن تمثيلها بأربع عمليات هي:
- انتقال مجموعة الأمين من الأحماض الامينية وتسمى هذه العملية Transamination وتتم داخل خلايا الجسم.
- أكسدة المجموعة الأمينية في خلايا الجسم وتسمى هذه العملية oxidative deamination
- بعد هاتين العمليتين تتم العملية الثالثة وهي انتقال الأمونيا بمجرى الدم و ذهابها إلى خلايا الكبد لتكوين اليوريا وتسمى ammonia transport.
- تفاعلات دورة اليوريا weacycle في خلايا الكبد.
ان مصير الأمونيا الناتجة من هدم الأحماض الامينية يكون
طرحها على حسب نوع الكائنات الحية وكما يلي :
اليوريا : هي الناتج النهائي لدورة اليوريا لعملية هدم وتحطيم
الأحماض الامينية في الأنسان والأحياء الأخرى المتقدمة الثديات وتسمى ureotelic organism.
إن حامض اليوريك هو الناتج النهائي لعملية هدم النتروجين
في الأحماض الامينية والنووية في الطيور و الزواحف وهي ليس لها مثانه يتم الإخراج عن
طريق البراز وتسمى uricotelic
organism.
إن الأمونيا هي الناتج النهائي لعملية هدم النتروجين في
الأحماض الامينية في الاسماك و الأسماك الفطية ويتم الأخراج عن طريق الخياشيم وتسمى
ammonotelic organisms
1- انتقال المجموعة الامينية Transamination
معظم الأحماض الامينية وليس كلها هي مواد خاضعة لأنزيمات
ال transominoses ماعدا حامض lysine و Threonine و proline و hydroxy proline و hydroxy lysine.
هناك انزيمان مهمان موجودان في أنسجة اللبائن يعملان على
المساعدة على انتقال المجموعة الأمينية بين معظم الأحماض الامينية ويكون تفاعل هذان
الانزيمان بأتجاهين (اتجاه التخليف و اتجاه الهدم) وهما glutamate transaminos و alanine transaminos
ولكل تفاعل يتم به نقل مجموعه امين بين حامضين انزيم متخصص
لهذا التفاعل فقط ويعتبر L-glutamate الحامض الاميني الوحيد في اللبائن
الذي يتم به عملية إزالة الامين التأكسدية oxidative deamination بمعدل مناسب.
2- إزالة مجموعة الامين المتأكسدة oxidative deamination
ان عملية إزالة مجموعة الأمين المتأكسدة من معظم الأحماض
الامينية تحصل في أنسجة الكبد و الكلية في الثديات، حيث تتحول الأحماض الامينية إلى
احماض كيتونيه او يمكن تكون عكسية بفعل انزيمات ال transaminose المذكوره سابقاً.
أن عملية ال oxidative
deamination تحصل بفعل انزيمات ال oxidase وهذه يوجد منها نوعان وهما :
D-amino acid oxidase & L-amino
acid oxidase
وهي موجودة في كبد الثديات والكلية وهي واسعة الأنتشار في
الانسجه للحيوانات والأحياء المجهرية.
إن انزيمات oxidase هي من نوع auto-oxidizable
flavo protein وتحصل عملية الأكسدة بتفاعلات انزيم ال oxidase حيث تحصل عملية إزالة الهيدروجين للأحماض الامينية
أولاً بفعل بروتين ال flavo protein الموجود بالأنزيم في عملية مشابهة (ل FAD و FMN) وتتحول هذه الأحماض إلى (a-amino
acids) وهذه العملية تلقائياً تضيف ماء إلى هذه المركبات وتتحول بذلك إلى
a-ketoacids التي بدورها تفقد مجموعة امين ألفا على شكل نتروجين
الأمونيا.
المصادر
- Berg JM, Tymoczko JL, Stryer L (2002). Biochemistry (5th ed.). New York: W.H. Freeman. ISBN 978-0716730514. OCLC 48055706.
- Protein Metabolism". Encyclopedia.com. 7 October 2020.
- Voet D, Pratt CW,
Voet JG (2013) [2012]. Fundamentals of biochemistry : life at the molecular
level (4th ed.). Hoboken, NJ: John Wiley & Sons. pp. 712–765. ISBN
9780470547847. OCLC 782934336.
- "Amino Acid
Synthesis". homepages.rpi.edu. Retrieved 2019-02-20.
- Brown TA (2002).
Genomes (2nd ed.). Oxford: Bios. ISBN 978-1859962282. OCLC 50331286.
- Chemistry for Biologists: Nucleic acids". www.rsc.org. Retrieved 2019-02-20.
- Griffiths AJ
(2000). An introduction to genetic analysis (7th ed.). New York: W.H. Freeman.
ISBN 978-0716735205. OCLC 42049331.
- Alberts B,
Johnson A, Lewis J, Raff M, Roberts K, Walter P. Molecular biology of the cell
(4th ed.). New York. ISBN 978-0815332183. OCLC 48122761.
- National Human Genome Research Institute (NHGRI)". National Human Genome Research Institute (NHGRI). Retrieved 2019-02-20.
- Cooper GM (2000).
The Cell: A Molecular Approach (2nd ed.). Washington, D.C.: ASM Press. ISBN
978-0878931194. OCLC 43708665.











Comments
Post a Comment